بخش نخست:
تعادل های شیمیایی ( جنبه های کیفی)
واکنش کامل واکنشی است که وقتی مواد اولیه به فراورده تبدیل می شود فراورده ها دیگر خود به خود به مواد اولیه تبدیل نمی شوند. مثلآ وقتی گاز کلر را با سدیم واکنش می دهیم تبدیل به سدیم کلرید(نمک خوراکی) می شود و نمک خودبه خود به سدیم فلزی و گاز کلر تبدیل نمی شود. خوبی این واکنش ها این است که ما به راحتی بر اساس معادله واکنش مقادیر مناسب از مواد اولیه را با هم ترکیب می کنیم و محصول لازم را با خلوص بالا به دست می آوریم.
اما در مقابل واکنش هایی هستند که وقتی مواد اولیه را با هم ترکیب می کنیم تا فراورده ها به دست آید مولکول های فراورده هم با هم برخورد می کنند و دوباره مواد اولیه به دست می آید و زمانی می رسد که تعداد مولکول های مواد اولیه که با هم برخورد می کنند و فراورده ها را می سازند برابر تعداد مولکول های فراورده ای می شوند که با هم برخورد کرده مواد اولیه را می سازند و عملآ واکنش دیگر پیش نمی رود در این حالت می گوییم واکنش به تعادل رسیده است. اشکال واکنش های تعادلی این است که همه ی مواد اولیه به فراورده تبدیل نمی شوند و حتی ما باید هزینه ای برای خالص سازی محصول بپردازیم به همین دلیل به روش های مختلف تلاش می کنیم یک واکنش تعادلی را هر چه بیشتر به سمت محصولات پیش ببریم.
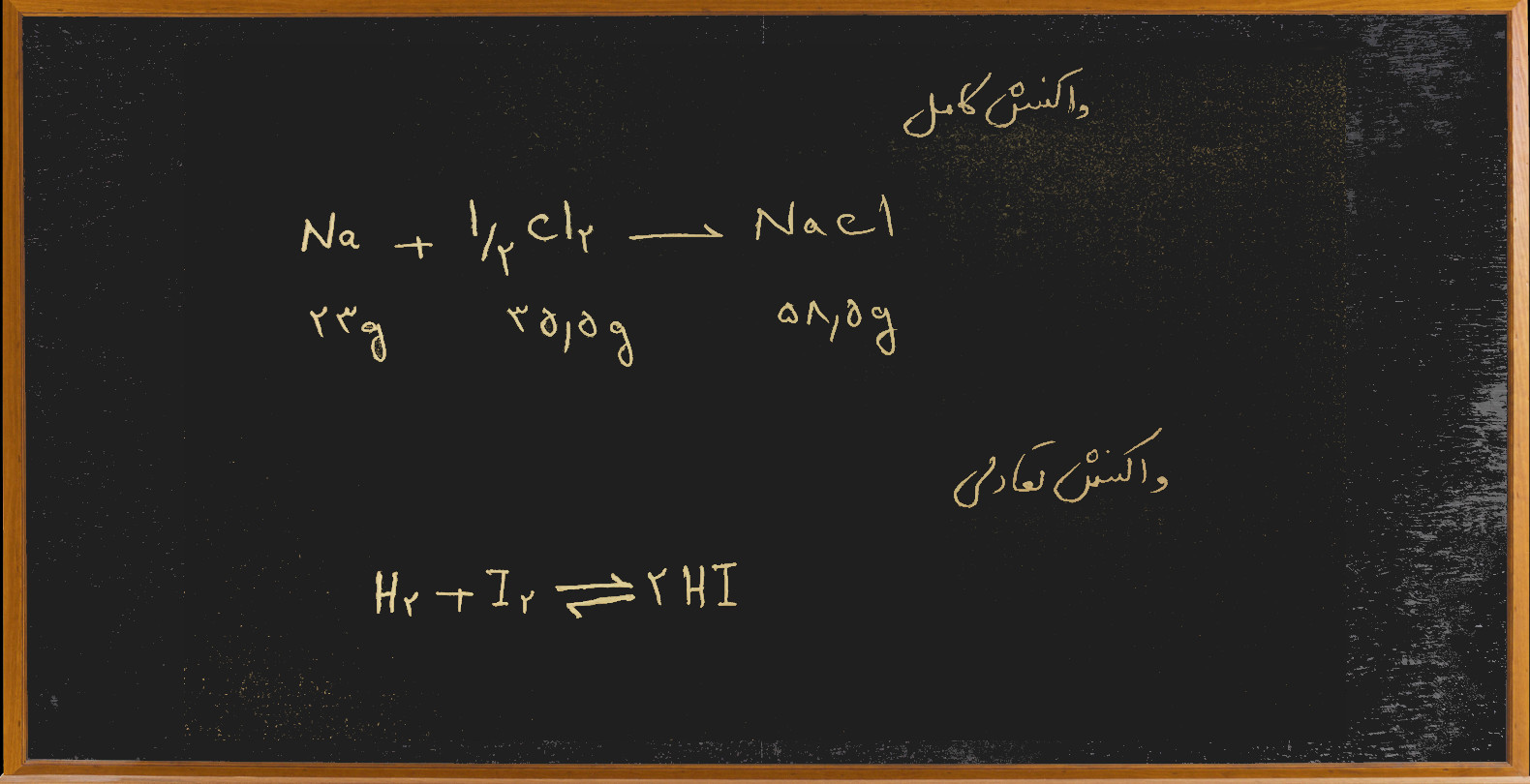
اصل لوشاتولیه: این دانشمند دریافت که اگر به یک واکنش در حال تعادل تغییری تحمیل شود واکنش در جهتی که تغییر تحمیل شده را جبران کند جابه جا می شود.
اصل لوشاتولیه و اثرغلظت: اگر غلظت یکی از مواد اولیه را زیاد و یا غلظت یکی از فراورده ها را کم کنیم واکنش در جهت محصول بیشتر پیش می رود.

اصل لوشاتولیه و اثر فشار: در مورد واکنش های گازی شکل که تعداد مول های گاز در دو طرف یکسان نباشد با تغییر فشار جهت تعادل عوض می شود.
اگر حجم گاز در طرف راست کمتر باشد، افزایش فشار واکنش را به سمت محصول بیشتر پیش می برد.
اگر حجم گاز در طرف راست بیشتر باشد، کاهش فشار واکنش را به سمت محصول بیشتر پیش می برد.
افزایش فشار= کاهش حجم

اصل لوشاتولیه و اثر دما: وا کنش های گرماده با کاهش دما به سمت فراورده ها پیش می رود و در واکنش های گرماگیر با افزایش دما واکنش به سمت محصول بیشتر پیش می رود.

اثر کاتالیزگر: کاتالیزگر جهت تعادل را تغییر نمی دهد فقط سرعت رسیدن به تعادل را تغییر می دهد.

